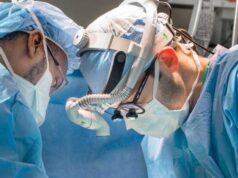
An der Cleveland Clinic wurden Atemwegs-Stents von dem Arzt Tom Gildea entwickelt, die mit einem 3D-Drucker hergestellt werden. Nun hat die U. S. Food and Drug Administration, die Lebensmittelüberwachungs- und Arzneimittelbehörde der Vereinigten Staaten, hat diese Stents für die Verwendung freigegeben.
Die Stents werden verwendet, um die Atemwege von Patienten mit schwerwiegenden Atemstörungen offen zu halten. Bisher wurden die patientenspezifischen Geräte im Rahmen des Compassionate-Use-Programms der FDA verwendet. Dies ermöglicht die Anwendung von medizinischen Geräten, die noch keine Freigabe habe. Vorausgesetzt ist hier, dass bei den Patienten keine verfügbaren Behandlungsformen mehr vorhanden sind.
Standard-Atemwegsstents gibt es in einer begrenzten Anzahl von Größen und Formen. Es ist jedoch so, dass nicht alle Patienten gleich sind und es somit keine perfekte Standard-Passform gibt. Gerade bei komplexen Erkrankungen sind schlecht sitzende Standardstents ein großes Problem.
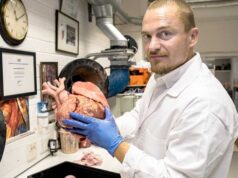
Die von Dr. Gildea und seinem Engineering-Team entwickelten patientenspezifischen Stents werden mithilfe von CT-Scans und proprietärer 3D-Visualisierungssoftware entwickelt. Die Formen für die Stents werden dann unter Verwendung eines 3D-Druckers gedruckt und mit medizinischem Silikon injiziert. Dieser Prozess ermöglicht es ihnen, sich der Anatomie eines Patienten perfekt anzupassen.
Ein weiterer Vorteil der patientenspezifischen Silikonstents besteht darin, dass sie für die Patienten angenehmer sind. Während Standard-Atemwegsstents häufiger gewechselt werden müssen, halten diese länger. In Studien konnten die patientenspezifischen Stents im Durchschnitt etwa ein Jahr verwendet werden. Standardstents hingegen nur 90 Tage.
Schätzungsweise 30.000 Atemwegsstents werden 2020 in den USA implantiert.