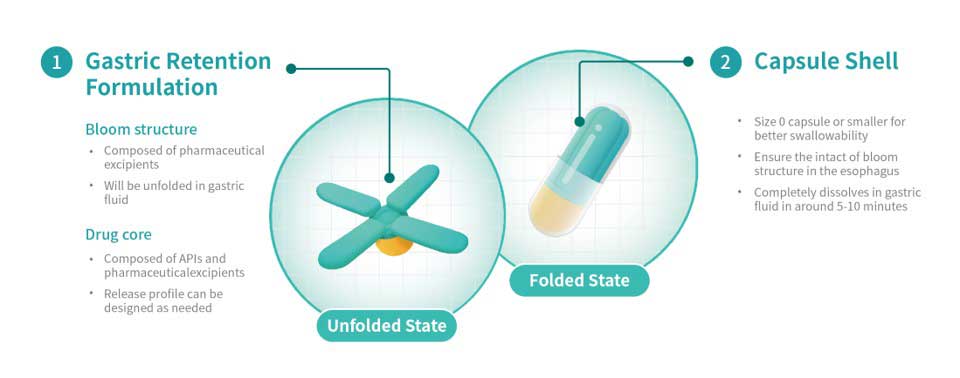
Das auf 3D-Druck spezialisierte Pharmaunternehmen Triastek gab bekannt, dass die US-Arzneimittelbehörde FDA grünes Licht für den Start klinischer Studien mit dem 3D-gedruckten Magenretention-Produkt T22 gegeben hat. Es handelt sich um die weltweit erste Zulassung eines 3D-gedruckten Magenretention-Produkts durch die FDA.
Bei T22 handelt es sich um ein Produkt zur Behandlung von Lungenhochdruckerkrankungen wie pulmonaler Hypertonie. Es basiert auf Triasteks innovativer MED&MIM-Technologie, die Schmelzextrusion mit Mikrospritzguss kombiniert. Im Vergleich zu herkömmlichen Darreichungsformen soll T22 eine verlängerte Magenverweildauer aufweisen und so die Einnahmehäufigkeit von drei auf einmal täglich reduzieren.
Laut Triastek-CEO Dr. Senping Cheng stellt die FDA-Zulassung einen wichtigen Schritt in der klinischen Entwicklung von T22 und der zugrundeliegenden Magenretentionstechnologie dar. Neben T22 verfügt Triastek bereits über drei weitere 3D-gedruckte Arzneimittelkandidaten in der klinischen Erprobung. Damit nimmt das Unternehmen eine Führungsposition im Bereich der 3D-gedruckten Medikamente ein.